- Författare Alex Aldridge [email protected].
- Public 2023-12-17 13:50.
- Senast ändrad 2025-06-01 07:38.
Den viktigaste skillnaden mellan kolsyra och bikarbonat är att kolsyra är en neutral kemisk förening, medan bikarbonat är en negativt laddad kemisk förening.
Kolsyra är en svag syra som bildas i lösning när koldioxid löses i vatten, med den kemiska formeln H2CO3. Bikarbonat bildas genom kombinationen av tre syreatomer, en väteatom och en kolatom med den kemiska formeln HCO3-.
Vad är kolsyra?
Kolsyra är H2CO3. Ibland ger vi detta namn till lösningar som har koldioxid löst i vatten eller kolsyrat vatten. Detta beror på att kolsyrat vatten innehåller en liten mängd H2CO3. Dessutom är kolsyra en svag syra, och den kan bilda två typer av s alter som karbonater och bikarbonater. Molmassan för denna förening är 62,024 g/mol.
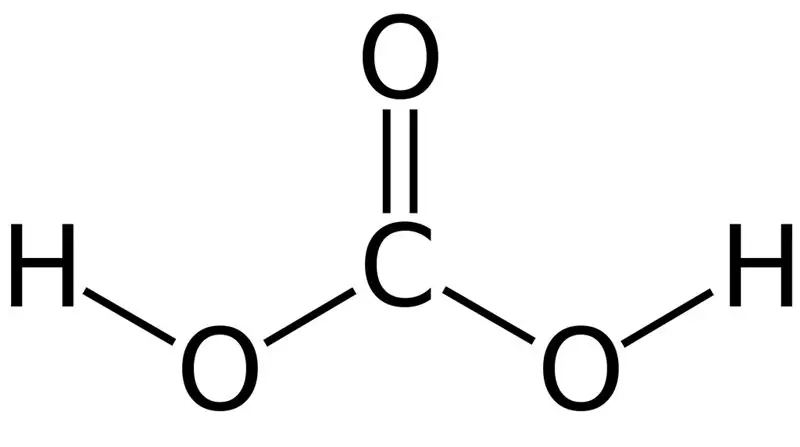
Figur 01: Kolsyrans kemiska struktur
När koldioxid löser sig i vatten kommer den in i en jämvikt mellan koldioxid och kolsyra. Jämvikten är som följer:
CO2 + H2O ⟷ H2CO3
Om vi tillsätter ett överskott av kolsyra till en bas ger det bikarbonat. Men om det finns ett överskott av bas, tenderar kolsyra att ge kolsyrade s alter. Mer exakt är kolsyra en karboxylsyraförening som har två hydroxylgruppsubstituenter bundna till karbonylkolet. Dessutom är det en polyprotisk syra, som kan donera protoner. Den har två avtagbara protoner, så den är specifikt diprotisk.
Vad är bikarbonat?
Bikarbonat bildas genom kombinationen av tre syreatomer, en väteatom och en kolatom. Produkten av denna kombination kan vara en jon eller en förening med fler elektroner än protoner. Vi kan beskriva det som en kemisk art med den kemiska formeln HCO3-.
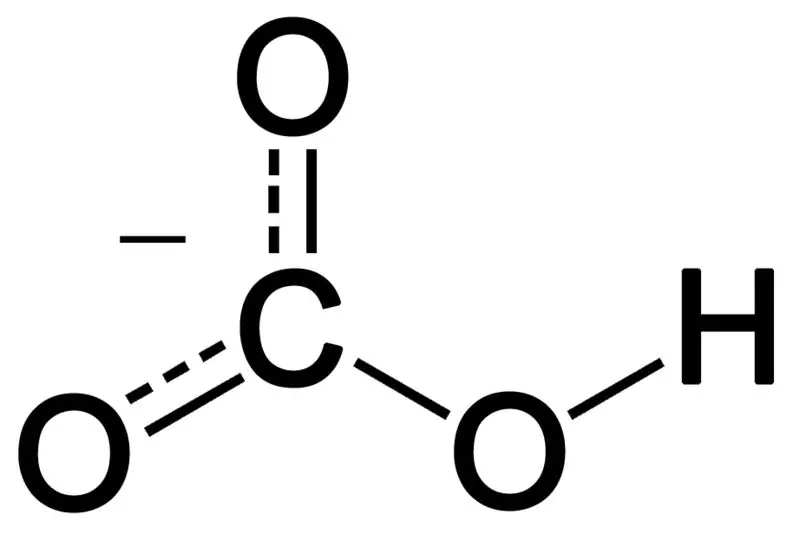
Figur 02: Bikarbonatanjonens kemiska struktur
Denna förening är en avgörande del av kroppens pH-buffringssystem, i lekmannatermer: den är ansvarig för att hålla ens blod i ett tillstånd som inte är för surt eller för basiskt. Dessutom fungerar det som ett sätt att hålla matsmältningsjuicerna i schack när magen har smält färdigt maten. Dessutom bildar kolsyra i regnvatten bikarbonatjoner när den träffar stenar. Detta flöde av bikarbonatjoner är viktigt för att hålla kolcykeln igång.
Vad är skillnaden mellan kolsyra och bikarbonat?
Kolsyra är en svag syra som bildas i lösning när koldioxid löses i vatten, och dess kemiska formel är H2CO3. Bikarbonat bildas genom kombinationen av tre syreatomer, en väteatom och en kolatom med den kemiska formeln HCO3-. Den viktigaste skillnaden mellan kolsyra och bikarbonat är att kolsyra är en neutral kemisk förening, medan bikarbonat är en negativt laddad kemisk förening. Dessutom används kolsyra för att göra bubbel, läskande drycker, behandla dermatitider, i munvatten, etc., medan bikarbonat används i matberedningar som bakning (som jäsmedel), och det ger förmågan att motstå förändringar i pH.
Följande infografik sammanfattar skillnaden mellan kolsyra och bikarbonat i tabellform för jämförelse sida vid sida.
Sammanfattning - Kolsyra vs bikarbonat
Kolsyra är H2CO3. Bikarbonat bildas genom kombinationen av tre syreatomer, en väteatom och en kolatom, med den kemiska formeln HCO3-. Den viktigaste skillnaden mellan kolsyra och bikarbonat är att kolsyra är en neutral kemisk förening, medan bikarbonat är en negativt laddad kemisk förening.






