- Författare Alex Aldridge [email protected].
- Public 2023-12-17 13:50.
- Senast ändrad 2025-06-01 07:38.
Nyckelskillnaden mellan alfa- och betahelix beror på vilken typ av vätebindning de bildar när de utvecklar dessa strukturer. Alfaspiraler bildar intramolekylära vätebindningar medan betaspiralerna bildar intermolekylära vätebindningar.
Komplexa proteiner har fyra strukturella organisatoriska nivåer - primär, sekundär, tertiär och kvartär. De sekundära strukturerna hos proteiner bildar peptidkedjorna i olika orienteringar. Peptidkedjorna består av aminosyrasekvenser bundna av peptidbindningar. Därför finns det två huvudsakliga sekundära strukturer i proteiner som alfahelix och betahelix. Dessutom finns det andra sekundära strukturer som kallas beta-sväng och hårnålsstrukturer. Den här artikeln fokuserar främst på skillnaden mellan alfa- och betahelix.
Vad är Alpha Helix?
Proteiner har fyra strukturella nivåer av organisation. Av dessa är alfahelixen den vanligaste sekundära strukturen av proteiner. Och denna struktur framstår som en stång som är lindad runt en central axel. Dessutom är alfaspiralen en högerhänt helix. Men vänsterhänta spiraler kan också vara närvarande. Här bildas peptidbindningarna från aminoterminalen till karboxiterminalen. Aminosyror länkar till varandra via dessa peptidbindningar. Intramolekylära vätebindningar är den främsta orsaken till att alfahelixen bildas.
Figur 01: Alpha Helix
Arrangemanget av alfahelixen beror på proteinets hydrofila och hydrofoba natur. Om aminosyrasekvensen består av ett stort antal hydrofila R (variabla) grupper, orienterar R-grupperna till vattenfasen. Om de variabla grupperna är hydrofoba, kommer de att sticka ut till den hydrofoba fasen av miljön. I båda scenarierna verkar R-grupperna sträcka sig ut ur den spiralformade strukturen. På grund av dessa strukturella egenskaper är alfahelix mer resistent mot mutationer. Således stabiliserar närvaron av vätebindningar alfahelixens struktur. Det finns i genomsnitt 3,6 rester per varv i en alfahelix eftersom det krävs 3,6 rester för att vätebindningarna ska utvecklas. Vissa strukturella proteiner som kollagen och keratin är rika på alfaspiraler.
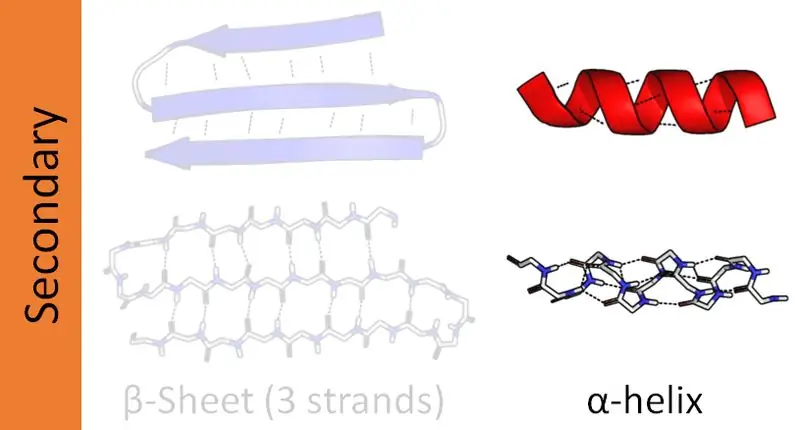
Vad är Beta Helix?
En betahelix är den näst vanligaste sekundära strukturen hos ett protein. Även om det inte är lika vanligt som alfa-helixen, spelar närvaron av beta-helixar också en stor roll i proteinstrukturen. Bildandet av beta-helixen sker via två beta-ark arrangerade antingen på ett parallellt sätt eller ett antiparallellt sätt. Dessa ark formas sedan till en spiralformad struktur. Intermolekylära vätebindningar mellan två arksträngar hjälper till att bilda en betahelix.

Figur 02: Beta Helix
Beta-spiraler kan vara både högerhänta och vänsterhänta beroende på deras bindningsmönster. När en beta-helix bildas, kommer de variabla grupperna i de två beta-arken att ordnas inom spiralens kärna. Därför har majoriteten av grupperna som bildar beta-ark hydrofoba funktioner.
I motsats till alfa-helixen bildar 17 rester ett varv i Beta-helixar. Metalljoner har förmågan att aktivera bildandet av Beta-helix. I likhet med alfahelixen stödjer vätebindningarna för att bibehålla strukturen hos betahelixen. Kolsyraanhydrasenzym och pektatlyas är två proteiner rika på beta-helixar.
Vilka är likheterna mellan Alpha och Beta Helix?
- Alpha och Beta Helix är två sekundära strukturer av proteiner.
- Aminosyror är monomererna i båda sekundära strukturerna.
- Dessutom är de kemiska beståndsdelarna i alfa- och beta-helixarna kol, väte, syre, kväve och svavel.
- De båda sekundära strukturerna utvecklas också till en organisation på högre nivå.
- Dessutom stabiliseras båda av vätebindningar.
- I båda strukturerna bestäms hydrofobiciteten av närvaron av R-grupperna i aminosyrorna.
Vad är skillnaden mellan Alpha och Beta Helix?
Nyckelskillnaden mellan alfa- och betahelixen är vilken typ av vätebindning de visar. Alfahelix visar intramolekylär vätebindning medan betahelix visar intermolekylär vätebindning. Dessutom bildar alfahelixen en högerhänt helix, medan betahelixen kan bilda både höger- och vänsterhänta helixar. Så detta är också en betydande skillnad mellan alfa- och betahelix.
Dessutom är en ytterligare skillnad mellan alfa- och beta-helix att alfa-helixbildningen sker genom vridning av aminosyrasekvensen, medan vid beta-helixbildning är de två betabladen antingen parallella eller antiparallella bundna till bildar den spiralformade strukturen.
Infografiken nedan visar mer information om skillnaden mellan alfa- och betahelix.

Sammanfattning - Alpha vs Beta Helix
Både alfa-helixar och beta-helixar är viktiga för att identifiera och härleda komplexa proteinstrukturer. Båda typerna är sekundära strukturer av proteiner. Men alfahelix är en spiralformad twist av aminosyrasekvenser. Däremot sker beta-helixbildning via vätebindning av parallella eller antiparallella beta-ark. Dessutom är vätebindningen intramolekylär i alfahelixform medan vätebindningen är intermolekylär i betahelixform. Dessutom har båda dessa strukturer en R-grupp, som bestämmer proteinets hydrofobicitet. Detta sammanfattar alltså skillnaden mellan alfa- och betahelix.






