- Författare Alex Aldridge [email protected].
- Public 2023-12-17 13:50.
- Senast ändrad 2025-06-01 07:38.
Key skillnad - Metan vs Ethane
Metan och etan är de minsta medlemmarna i alkanfamiljen. Molekylformlerna för dessa två organiska föreningar är CH4 respektive C2H6. Den viktigaste skillnaden mellan metan och etan är deras kemiska struktur; en etanmolekyl kan betraktas som två metylgrupper sammanfogade som en dimer av metylgrupper. De andra kemiska och fysikaliska skillnaderna uppstår främst på grund av denna strukturella skillnad.
Vad är metan?
Metan är den minsta medlemmen i alkanfamiljen med den kemiska formeln CH4 (fyra väteatomer är bundna till en kolatom). Det anses vara huvudkomponenten i naturgas. Metan är en färglös, luktfri och smaklös gas; även känd som karbane, kärrgas, naturgas, koltetrahydrid och vätekarbid. Den kan lätt antändas och dess ånga är lättare än luften.
Metan finns naturligt under marken och under havsbotten. Atmosfärens metan anses vara en växthusgas. Metan bryts ner till CH3- med vatten i atmosfären.
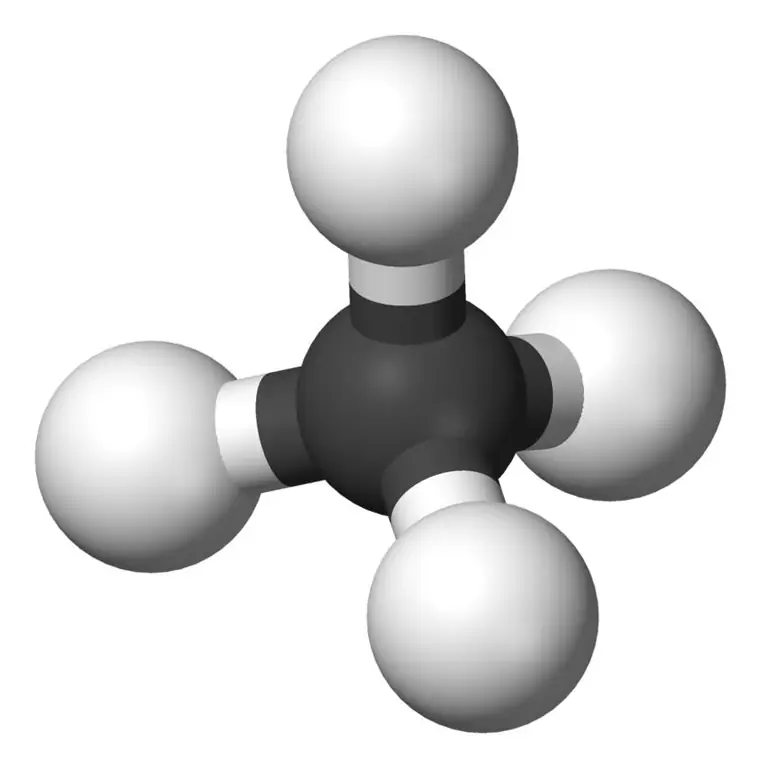
Vad är Ethane?
Etan är en färglös, luktfri gasformig förening vid standardtemperatur och -tryck. Dess molekylformel och molekylvikt är C2H6 respektive 30,07 g·mol−1. Det är isolerat från naturgas, som en biprodukt från petroleumraffineringsprocessen. Etan är mycket viktigt vid etenproduktion.
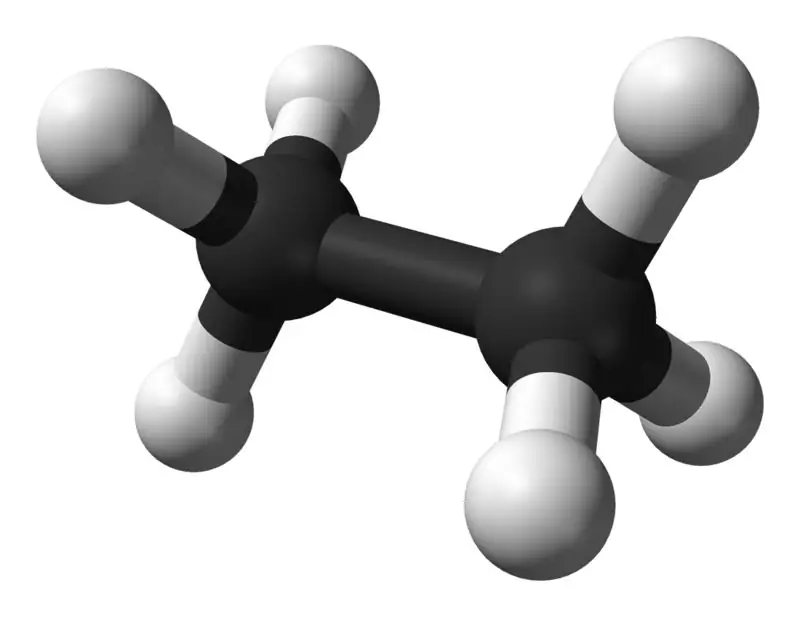
Vad är skillnaden mellan metan och etan?
Karakteristika för metan och etan
Structure:
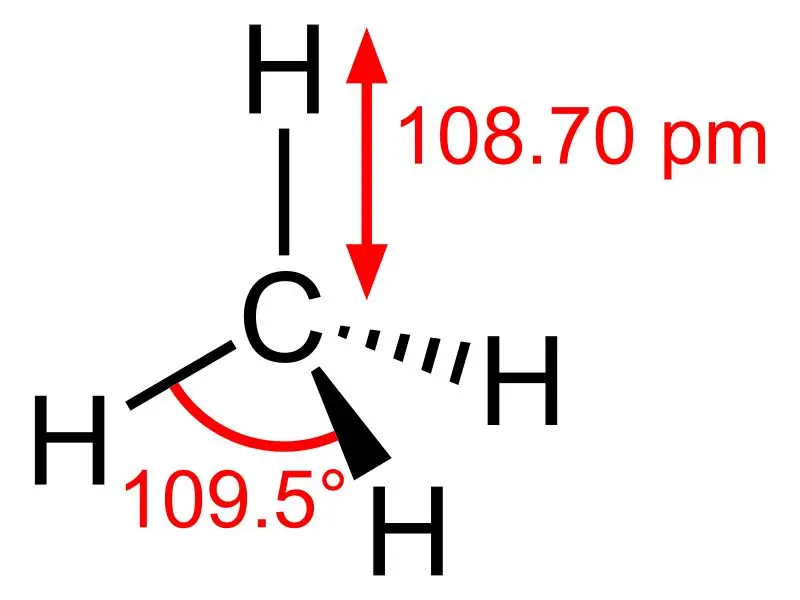
Metan: Molekylformeln för metan är CH4, och det är ett exempel på en tetraedrisk molekyl med fyra ekvivalenta C-H-bindningar (sigmabindningar). Bindningsvinkeln mellan H-C-H-atomer är 109,50 och alla C-H-bindningar är ekvivalenta, och den är lika med 108,70 pm.
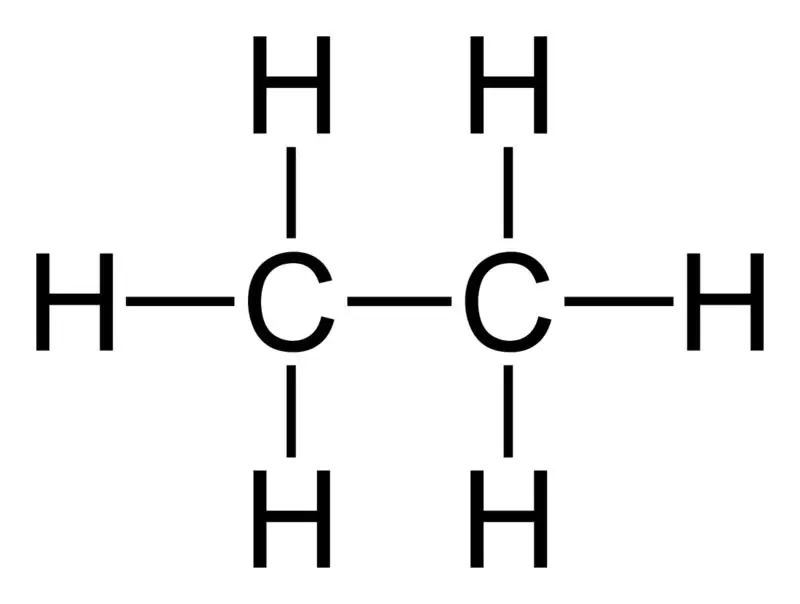
Etan: Molekylformeln för etan är C2H6,och det är ett mättat kolväte eftersom det inte innehåller flera bindningar.
Kemiska egenskaper:
Metan:
Stabilitet: Metan är en kemiskt mycket stabil molekyl som inte reagerar med KMnO4, K2Cr 2O7, H2SO4 eller HNO 3 under normala förhållanden.
Förbränning: I närvaro av överskott av luft eller syre brinner metan med en ljusblå icke-lysande låga som producerar koldioxid och vatten. Det är en mycket exoterm reaktion; därför används det som ett utmärkt bränsle. I närvaro av otillräcklig luft eller syre förbränns den delvis till kolmonoxidgas (CO).
Substitutionsreaktioner: Metan visar substitutionsreaktioner med halogener. I dessa reaktioner ersätts en eller flera väteatomer med lika många halogenatomer och det kallas halogenering.” Den reagerar med klor (Cl) och brom (Br) i närvaro av solljus.
Reaktion med ånga: När en blandning av metan och ånga leds genom ett uppvärmt (1000 K) nickel som stöds på aluminiumoxidytan, kan det producera väte.
Pyrolys: När metan värms upp till cirka 1300 K, sönderdelas det till kimrök och väte.
Ethane:
Reaktioner: Etangas (CH3CH3) reagerar med bromånga i närvaro av ljus för att bilda brometan, (CH 3CH2Br) och vätebromid (HBr). Det är en substitutionsreaktion; en väteatom i etan är substituerad med bromatom.
CH3CH3 + Br2 à CH3 CH2Br + HBr
Förbränning: Den fullständiga förbränningen av etan producerar 1559,7 kJ/mol (51,9 kJ/g) värme, koldioxid och vatten.
2 C2H6 + 7 O2 → 4 CO 2 + 6 H2O + 3120 kJ
Det kan också förekomma utan överskott av syre, vilket ger en blandning av amorft kol och kolmonoxid.
2 C2H6 + 3 O2 → 4 C + 6 H 2O + energi
2 C2H6 + 5 O2 → 4 CO + 6 H 2O + energi
2 C2H6 + 4 O2 → 2 C + 2 CO + 6 H2O + energi etc.
Definitioner:
Substitutionsreaktioner: Substitutionsreaktion är en kemisk reaktion som involverar förskjutning av en funktionell grupp i en kemisk förening och ersätt den med en annan funktionell grupp.
Användar:
Metan: Metan används i många industriella kemiska processer (som bränsle, naturgas, flytande naturgas) och det transporteras som en kyld vätska.
Etan: Etan används som bränsle för motorer och som köldmedium för ett system med extremt låga temperaturer. Den levereras i stålcylindrar som en flytande gas under sitt eget ångtryck.






