- Författare Alex Aldridge [email protected].
- Public 2023-12-17 13:50.
- Senast ändrad 2025-06-01 07:38.
nyckelskillnad - stark ligand vs svag ligand
En ligand är en atom, jon eller en molekyl som donerar eller delar två av sina elektroner genom en koordinatkovalent bindning med en central atom eller jon. Begreppet ligander diskuteras under koordinationskemi. Ligander är kemiska arter som är involverade i bildandet av komplex med metalljoner. Därför är de också kända som komplexbildare. Ligander kan vara Monodentate, Bidentate, Tridentate, etc. baserat på ligandens denticitet. Denticitet är antalet givargrupper som finns i en ligand. Monodentat betyder att liganden endast har en givargrupp. Bidentate betyder att den har två donatorgrupper per en ligandmolekyl. Det finns två huvudtyper av ligander kategoriserade baserat på kristallfältsteori; starka ligander (eller starka fältligander) och svaga ligander (eller svaga fältligander). Den viktigaste skillnaden mellan starka ligander och svaga ligander är att uppdelningen av orbitaler efter bindning till en starkfältligand orsakar en högre skillnad mellan orbitaler med högre och lägre energinivå, medan uppdelningen av orbitaler efter bindning till en svagfältligand orsakar en lägre skillnad mellan orbitaler med högre och lägre energinivå.
Vad är Crystal Field Theory?
Kristallfältteori kan beskrivas som en modell som är utformad för att förklara brytningen av degenerationer (elektronskal med lika energi) av elektronorbitaler (vanligtvis d- eller f-orbitaler) på grund av det statiska elektriska fältet som produceras av en omgivande anjon eller anjoner (eller ligander). Denna teori används ofta för att demonstrera beteendet hos komplex av övergångsmetalljoner. Denna teori kan förklara de magnetiska egenskaperna, färgerna på koordinationskomplex, hydratiseringsentalpier, etc.
Teori:
Interaktionen mellan metalljonen och liganderna är ett resultat av attraktionen mellan metalljonen med en positiv laddning och den negativa laddningen av ligandens oparade elektroner. Denna teori är huvudsakligen baserad på de förändringar som sker i fem degenererade elektronorbitaler (en metallatom har fem d-orbitaler). När en ligand kommer nära metalljonen är de oparade elektronerna närmare vissa d-orbitaler än andra d-orbitaler i metalljonen. Detta orsakar en förlust av degeneration. Och även elektronerna i d-orbitalen stöter bort elektronerna i liganden (eftersom båda är negativt laddade). Därför har d-orbitaler som är närmare liganden hög energi än andra d-orbitaler. Detta resulterar i att d-orbitaler delas upp i d-orbitaler med hög energi och d-orbitaler med låg energi, baserat på energin.
Några faktorer som påverkar denna uppdelning är; metalljonens natur, metalljonens oxidationstillstånd, arrangemanget av ligander runt den centrala metalljonen och ligandernas natur. Efter uppdelningen av dessa d-orbitaler baserat på energi, är skillnaden mellan hög- och lågenergi-d-orbitaler känd som en kristallfältsdelningsparameter (∆oct för oktaedriska komplex).
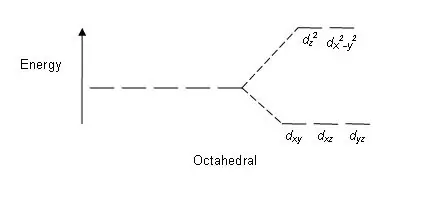
Figur 01: Delningsmönster i oktaedriska komplex
Klyvningsmönster: Eftersom det finns fem d-orbitaler, sker klyvningen i förhållandet 2:3. I oktaedriska komplex är två orbitaler i den höga energinivån (kollektivt känd som "eg") och tre orbitaler är i den lägre energinivån (kollektivt känd som t2g). I tetraedriska komplex inträffar det motsatta; tre orbitaler är i den högre energinivån och två i den lägre energinivån.
Vad är Strong Ligand?
En stark ligand eller en stark fältligand är en ligand som kan resultera i en högre kristallfältsdelning. Detta betyder att bindningen av en stark fältligand orsakar en högre skillnad mellan orbitaler med högre och lägre energinivå. Exempel inkluderar CN- (cyanidligander), NO2- (nitroligand) och CO (karbonyl) ligander).
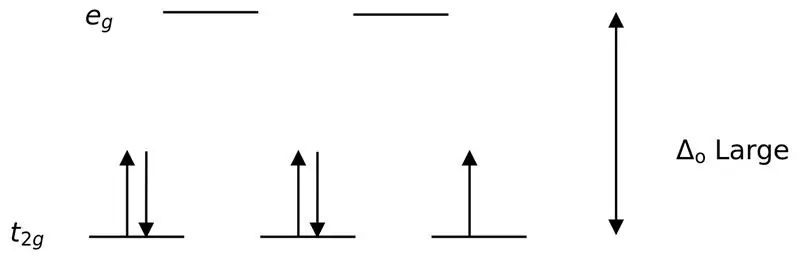
Figur 02: Lågt spinndelning
Vid bildningen av komplex med dessa ligander fylls till en början de lägre energiorbitalerna (t2g) helt med elektroner innan de fylls till andra orbitaler med hög energinivå (t.ex.). De komplex som bildas på detta sätt kallas "lågspinnkomplex".
Vad är svag ligand?
En svag ligand eller en svag fältligand är en ligand som kan resultera i en lägre kristallfältsdelning. Detta betyder att bindningen av en svag fältligand orsakar en lägre skillnad mellan orbitaler med högre och lägre energinivå.
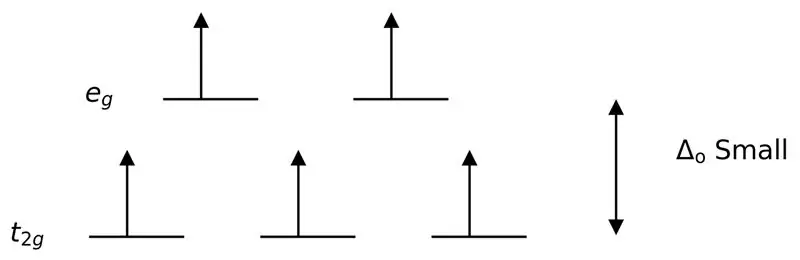
Figur 3: High Spin Splitting
I det här fallet, eftersom den låga skillnaden mellan de två orbitalnivåerna orsakar repulsioner mellan elektroner i dessa energinivåer, kan orbitaler med högre energi lätt fyllas med elektroner jämfört med orbitaler med låg energi. De komplex som bildas med dessa ligander kallas "högspinnkomplex". Exempel på svaga fältligander inkluderar I- (jodidligand), Br- (bromidligand), etc.
Vad är skillnaden mellan stark ligand och svag ligand?
Strong Ligand vs Weak Ligand |
|
| En stark ligand eller en stark fältligand är en ligand som kan resultera i en högre kristallfältsdelning. | En svag ligand eller en svag fältligand är en ligand som kan resultera i en lägre kristallfältsdelning. |
| Teori | |
| Klyvningen efter bindning av en stark fältligand orsakar en större skillnad mellan orbitaler med högre och lägre energinivå. | Klyvningen av orbitaler efter bindning av en svag fältligand orsakar en lägre skillnad mellan orbitaler med högre och lägre energinivå. |
| Kategori | |
| Komplexen som bildas med starka fältligander kallas "lågspinnkomplex". | Komplexen som bildas med svaga fältligander kallas "högspinnkomplex". |
Sammanfattning - Stark Ligand vs Weak Ligand
Starka ligander och svaga ligander är anjoner eller molekyler som orsakar uppdelning av d orbitaler av en metalljon i två energinivåer. Skillnaden mellan starka ligander och svaga ligander är att splittringen efter bindning av en stark fältligand orsakar en högre skillnad mellan orbitaler med högre och lägre energinivå, medan delning av orbitaler efter bindning av en svag fältligand orsakar en lägre skillnad mellan högre och lägre energinivå. orbitaler på energinivå.






